Cualquiera que haya montado claras a punto de nieve para algún dulce o que haya hecho merengue ha escuchado o leído que conviene añadir:
- Una pizca de sal o
- algo de zumo de limón o
- cremor tártaro o
- unas gotas de vinagre
para que monten mejor… en resumen, para que la espuma que forman sea más estable, pero ¿qué sentido tiene esto?
Índice
¿Qué es una espuma?
Conocemos la espuma del mar, la espuma que se forma en la bañera cuando ponemos jabón… ¿pero en qué consiste exactamente?
- ¿Qué pasa cuando chapoteamos o batimos agua pura?
- Poco, conseguiremos introducir alguna que otra burbuja de aire que durará un momento en el seno del líquido, pues tenderá a subir hacia la superficie por la tensión superficial y por la diferencia de densidad entre el líquido y el aire.
- ¿Qué ocurre si a ese líquido le añadimos una sustancia como el jabón?
- Que si chapoteamos aparecerá más o menos espuma en la superficie del agua. ¿Os habéis preguntado alguna vez por qué?
Las burbujas que introducimos en el seno del líquido al agitarlo tienden a subir, pero en el camino quedan recubiertas por el jabón tal como se ve en el siguiente dibujo (esas cosas como alfilerillos con cabeza gorda son las moléculas de jabón). Pero ¿por qué ocurre esto?
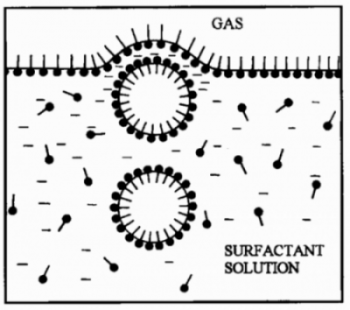
Fuente: Foams. Harvard University
Las moléculas de los compuestos espumantes como el jabón (o las proteínas de la clara, como veremos más adelante) tienen dos partes:
- Un lado con afinidad por el agua (hidrófilo o polar), la cabeza de los alfilerillos.
- Un lado que repele el agua (hidrófobo o apolar), el cuerpo lineal de los alfilerillos.
Al encontrarse las burbujas en su ascensión con la sustancia espumante (el jabón) dispersa en el agua:
- La parte de la molécula de jabón que tiene manía al agua busca con desesperación colocarse dentro de la burbuja de aire (parte lineal) para huir del agua y
- la sección que hace buenas migas con el agua se coloca dentro de ella (parte redondita).
El resultado: las burbujillas se recubren con una capa de espumante que las estabiliza y no explotan al llegar a la superficie del agua, sino que se amontonan como bien sabemos por nuestra experiencia, formando una capa de espuma.
Las moléculas del jabón se colocan (se adsorben) sobre las burbujas de aire sujetando sobre ellas una fina capa de agua, formando pompas. Por eso cuando se explota una pompa de jabón voladora nos salpica, porque lleva agua en su superficie. Sí, esa superficie irisada de las pompas es agua con jabón.
No, no voy a hablar de que el efecto del espumante o surfactante o tensioactivo es reducir la tensión superficial… porque no quiero que me odiéis. Si es que queda alguien leyendo esto a estas alturas.
La clara de huevo forma espumas
La clara de huevo tiene la siguiente composición tipo:
- Agua – 87%
- Proteínas – 12%
- Otros – 1%
Es decir, que es básicamente agua con proteínas flotando.
¿Por qué las claras forman espumas? Porque tienen en su composición unas encantadoras proteínas que actúan como espumantes, tal como he explicado antes, con sus dos lados en la molécula, uno hidrófilo y otro hidrófobo, su camisita y su canesú.
¿Qué ocurre cuando batimos agua con proteína de clara (claras de huevo, en definitiva)? Que obtenemos una espuma fina y relativamente estable.
¿Qué ocurre al batir las claras de huevo?
- Las proteínas de las claras son moléculas enormes que yo me imagino como un estropajo de aluminio, así de intrincadas y revueltas.
- Por la acción mecánica del batido estas proteínas pierden su forma de madeja (se desnaturalizan) y se estiran en largos filamentos que se unen y enredan unos con otros.
- Las zonas hidrófobas de las proteínas que detestan el contacto con el agua y que suelen estar en el interior de la madeja quedan expuestas al estirarse la proteína. El resultado es que se colocan sobre las burbujas de aire para huir del contacto con el agua.
- Al unirse estos filamentos entre sí mediante enlaces químicos y eléctricos, y colocarse sobre las burbujas de aire, las sujetan y estabilizan.
- Gracias a estas simpáticas proteínas somos capaces de incorporar a las claras líquidas un montón de aire que multiplica el volumen de la mezcla y que obra maravillas al hornearla.

¿Por qué es útil añadir un ácido?
Los ácidos como el zumo de limón (ácido cítrico), el vinagre y el cremor tártaro liberan iones H+ en el agua (disminuyen el pH) que producen varios efectos:
- Ayudan a desnaturalizar las proteínas, a que se desenreden y queden al aire las zonas hidrófobas que prefieren ponerse mirando al aire de las burbujas.
- Neutralizan las cargas de las proteínas disminuyendo la repulsión entre ellas y aumentando su tendencia a combinarse y formar redes alrededor de las burbujas.
- Si estas uniones se multiplican y se hacen fuertes (con enlaces S-S, entre átomos de azufre de la cisteína, en lugar de puentes de hidrógeno) las proteínas se pueden unir más íntimamente y liberar las burbujas, deshaciendo la espuma. Los iones H+ evitan que se formen demasiados enlaces fuertes, favoreciendo que se mantengan las proteínas unidas, pero en su justa medida (con puentes de hidrógeno).
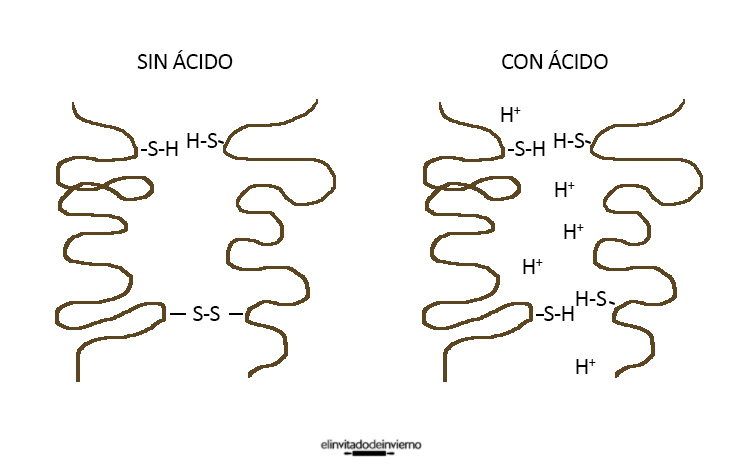
Fuente: Scientifically Sweet
¿Y qué pasa con la pizca de sal?
La sal no es un ácido, pero al disolverse en el agua de la clara neutraliza la carga de las proteínas y aumenta su atracción por las burbujas de aire.
Aunque he encontrado también bibliografía que dice justo lo contrario, que la sal es perjudicial para el montado de claras. ¿Es errónea entonces la sabiduría popular en este caso? Seguiré estudiando el tema.
Referencias
- Beating egg whites. KitchenSavvy
- Know your foam. Scientifically Sweet
- Espumas. Ciencia con buen gusto
- Espuma de clara de huevo. Fundamentos químicos de la ingeniería




